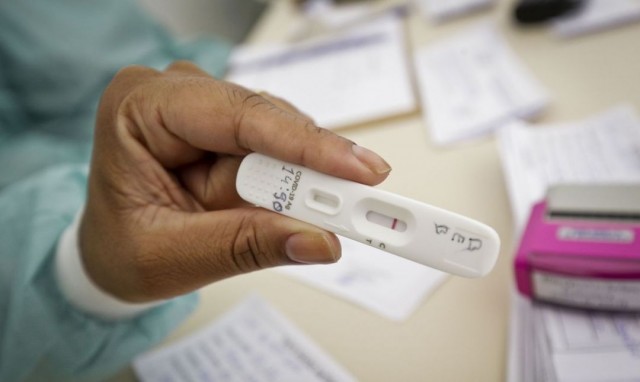
Entretanto, isso não ocorrerá de forma imediata -cada empresa precisará solicitar o registro na agência reguladora para comercializar o produto
A diretoria colegiada da Anvisa (Agência Nacional de Vigilância Sanitária) autorizou de maneira unânime a venda de autoteste no Brasil como uma forma de triagem da Covid-19. Entretanto, isso não ocorrerá de forma imediata -cada empresa precisará solicitar o registro na agência reguladora para comercializar o produto.
A decisão ocorreu após o Ministério da Saúde enviar uma nova nota técnica com proposta de política pública para utilização do exame na noite de terça-feira (25). A Anvisa não aprovou a venda de autoteste de Covid-19 no Brasil em 19 de janeiro. A leitura na ocasião foi de que a nota técnica do Ministério da Saúde apresentava lacunas, por exemplo, sobre como notificar a confirmação da infecção e de que forma orientar os pacientes.
O autoteste servirá para ampliar a testagem de indivíduos sintomáticos, assintomáticos e seus possíveis contatos. Dessa forma, poderia ocorrer o isolamento precoce e a quebra de cadeia de transmissão. Segundo a decisão da Anvisa, o autoteste poderá ser comercializado apenas em farmácias com e sem manipulação e estabelecimentos de saúde licenciados. Esses estabelecimentos licenciados também poderão vender pela internet.
O gerente-geral de Tecnologia de Produtos para a Saúde, Leandro Rodrigues, afirmou que é possível que a agência autorize algum autoteste ainda em fevereiro. A informação foi dada em entrevista coletiva após a aprovação da venda do produto. “A gente está na expectativa de receber já no início da próxima semana os primeiros processos de registros de autotestes e já iniciar a análise. A análise será iniciada de imediato em prioridade e imagina que durante o mês de fevereiro já tenha produtos aprovados”, disse Rodrigues.
Como o jornal Folha de S.Paulo mostrou, o setor já está se preparando para atender o mercado. O presidente-executivo da CBDL (Câmara Brasileira de Diagnóstico Laboratorial), Carlos Gouvêa, estimou que a indústria instalada no Brasil tem capacidade de produzir até 10 milhões de autotestes de Covid por mês.
Disse ainda que os autotestes devem ser mais baratos que exames de antígeno vendidos em farmácia. O Ministério da Saúde já sinalizou que não pretende comprar o autoteste para distribuir à população. Mas aprova sua comercialização no país para ampliar a política de testagem.
O CNS (Conselho Nacional de Saúde) publicou, porém, recomendação nesta sexta-feira (28) para que o Ministério da Saúde disponibilize o autoteste no SUS. O entendimento é que a pasta tem que ser braço da política pública e o autoteste não podendo ser usado apenas por quem tem condição financeira de comprá-lo.
Além disso, o conselho recomendou que a pasta disponibilize o acesso massivo aos testes RT-PCR para diagnóstico e o teste rápido para o controle da Covid-19. O Ministério da Saúde foi procurado para comentar a recomendação do CNS, mas respondeu até a publicação da reportagem. Ficou acordado entre Anvisa e Ministério da Saúde que haverá a inclusão de orientações sobre o autoteste em um novo capítulo do PNE (Plano Nacional de Expansão da Testagem para Covid-19).
“O uso de autoteste para pesquisa de antígeno de Sars-Cov-2 passará a integrar a política pública do Ministério da Saúde de combate à pandemia de Covid-19 como um eixo de apoio ao diagnóstico”, disse o diretor Rômison Mota. Como foi informado na nota técnica do Ministério da Saúde, o autoteste passará a ser uma nova ferramenta de triagem do PNE. Dessa forma, a pessoa a partir do resultado positivo deve procurar uma unidade de atendimento de saúde ou teleatendimento para que um profissional da saúde realize a confirmação do diagnóstico, notificação e orientações pertinentes de vigilância e assistência em saúde.
Com isso, não seria obrigatório informar o resultado do autoteste ao Ministério da Saúde.
A diretora relatora, Cristiane Rose Jourdan Gomes, destacou que o autoteste servirá para ampliar a testagem de indivíduos sintomáticos, assintomáticos e seus possíveis contatos, independente do estado vacinal. Sendo que, em menores de 14 anos de idade, o exame deve ser realizado com a supervisão e apoio dos pais. Dessa forma, poderia ocorrer o isolamento precoce e a quebra de cadeia de transmissão.
“Considerando o exponencial aumento de casos em decorrência da variante ômicron, a elaboração das diretrizes do Ministério da Saúde sobre o uso do autoteste relacionada à política de testagem para a Covid e a missão institucional da Anvisa na proteção da saúde público, entendo relevante e urgente a abertura de processo regulatório e deliberação da diretoria colegiada que dispõe sobre o registro e dispositivos de autoteste”, disse.
A liberação ocorre no momento em que há uma explosão da procura por testes da Covid-19 com o avanço da variante ômicron. Laboratórios privados têm relatado falta dos exames. A testagem no Brasil está centrada em clínicas, farmácias e serviços públicos, que não estão conseguindo atender à demanda diante da circulação da ômicron.
Entidades científicas cobraram uma política de testagem mais ampla do governo federal e a permissão do exame em casa. A procura pelos testes disparou com o avanço da contaminação na virada do ano.